"Химия. 11 класс". О.С. Габриелян (гдз)
Скорость реакции. Смещение химического равновесия
Вопрос 1.
1) а) вправо, потому что данная реакция протекает с выделением теплоты;
б) вправо, потому что данная реакция протекает с уменьшением объёма.
2) а) влево, потому что данная реакция протекает с поглощением теплоты;
б) не сместится, потому что данная реакция протекает без изменения объёма.
3) а) влево, потому что данная реакция протекает с поглощением теплоты;
б) влево, потому что данная реакция протекает с увеличением объёма.
Вопрос 2.
1) вправо, потому что данная реакция протекает с уменьшением объёма.
2) вправо, потому что данная реакция протекает с уменьшением объёма, с образованием жидкого вещества.
3) не повлияет, потому что данная реакция протекает без изменения объёма.
4) вправо, потому что данная реакция протекает с уменьшением объёма.
Вопрос 3.
Для того, чтобы сместить вправо, необходимо:
1) увеличить концентрацию РСI5, потому что при увеличении концентрации реагирующих веществ химическое смещается в сторону образования продуктов реакции;
2) уменьшить концентрацию РСl3 и Сl2, потому что при уменьшении концентрации продуктов реакции химическое равновесие системы смещается в сторону их образования;
3) понизить давление, потому что при уменьшении давления химическое смещается в сторону той реакции, при которой объем образующихся газообразных веществ больше;
4) повысить температуру, потому что при повышении температуры химическое смещается в сторону .
Вопрос 4.
Не вызовет нарушения равновесия системы изменение давления в следующих реакциях:
1) HCOOH + C2H5OH ↔ HCOOC2H5 + H2O,
потому что в данной реакции не участвуют газы, следовательно, состояние химического равновесия реакции не зависит от давления;
2) 3Fe + 4H2O(г) ↔ Fe3O4 + 4H2(г),
потому что данная реакция протекает без изменения объёма системы.
Вопрос 5.
Уравнение реакции имеет вид:
H2 + J2 ↔ 2HJ.
По уравнению реакции выходит, что на образование одного моля иодоводорода затрачивается 1/2 моля водорода и йода. Следовательно, на образование 0,09 моль HJ потратилось по 0,09/2 моль H2 и J2. Исходная концентрация реагирующего вещества равна суме равновесной концентрации и количеству прореагировавшего вещества.
Тргда
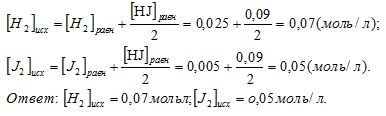
Вопрос 6.
Для реакции:
2NO2 ↔ 2NO + O2
Выражение константы равновесия имеет вид:
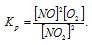
По уравнению реакции выходит, что из одной молекулы NO2 образуется две молекулы O2. Тогда исходная концентрация NO2 равна сумме равновесной концентрации NO2 и удвоенной равновесной
концентрации O2.
Тогда
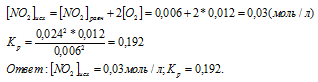
Вопрос 7.
Обозначим: V1 - скорость прямой реакции при данной температуре,
а V2 - скорость обратной реакции. Когда система находится в равновесии, то V1 = V2. При повышении температуры на 30 oC скорость прямой реакции увеличится в
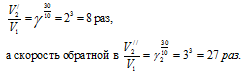
Так как увеличение скорости обратной реакции больше увеличения скорости прямой реакции, то равновесие сместится влево.
Вопрос 8.
Уменьшение концентраций веществ в газовой системе в 2 раза соответствует уменьшению давления в 2 раза. Прямая реакция идет с уменьшением числа молекул в газовой фазе, поэтому уменьшение давления приведет к смещению равновесия влево.
Ответ: сместится влево.

