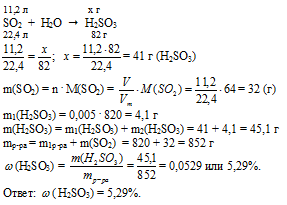"Химия. 11 класс". О.С. Габриелян (гдз)
Степень электролитической диссоциации
Вопрос 1.
в бескислороднных кислотах зависит от полярности связи Н— Х: чем меньше разность , тем сильнее кислота, а также от радиуса атома элемента: чем больше радиус, тем сильнее кислота. В кислородсодержащих кислотах тем больше, чем больше количество атомов кислорода связано с элементом, Х =О так как они поляризуют связь О — Н. Например,
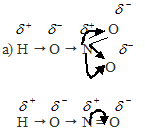
В азотной кислоте HNO3 1 атом кислорода связан с атомом азота и кислорода, а 2 других атома кислорода связаны с атомом азота (помимо Н — О), они, эти два атома кислорода, оттягивают на себя электронную плотность, и тем самым сильно поляризуя связь Н—О. А в молекуле азотистой кислоты HNO2 такой атом кислорода один, поэтому связь Н—О здесь менее полярна, а следовательно и степень диссоциации меньше.
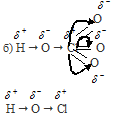
Рассуждая аналогично, приходим к выводу, что HClO4 значительно больше степени диссоциации HClO.
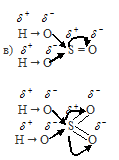
серной кислоты H2SO4 будет значительно больше степени диссоциации сернистой кислоты H2SO3.
Вопрос 2.
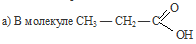 углеводородный радикал влияет на карбоксил, так как, являясь предельным, отталкивает от себя электронную плотность (обладает +I эффектом),, тем самым уменьшая полярность связи О—Н, кислота становится слабее кислоты
углеводородный радикал влияет на карбоксил, так как, являясь предельным, отталкивает от себя электронную плотность (обладает +I эффектом),, тем самым уменьшая полярность связи О—Н, кислота становится слабее кислоты 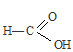 , где углеводородный радикал отсутствует, а следовательно нет такого отталкивания электронной плотности на карбоксил, и тем самым полярность связи О—Н значительно больше, поэтому муравьиная кислота является более сильной кислотой, чем пропионовая (НСООН – кислота средней силы).
, где углеводородный радикал отсутствует, а следовательно нет такого отталкивания электронной плотности на карбоксил, и тем самым полярность связи О—Н значительно больше, поэтому муравьиная кислота является более сильной кислотой, чем пропионовая (НСООН – кислота средней силы).
б) Карбоксил в свою очередь влияет на радикал, так как оттягивает электронную плотность на себя, тем самым делая подвижным -водородные атомы, которые могут замещаться на атомы галогенов.
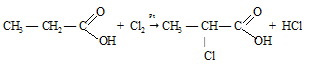
в) Карбоксильная группа влияет на гидроксильную группу, так как оттягивая на себя электронную плотность и делает связь О—Н менее прочной. Чем, например в спиртах.
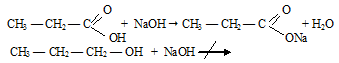
г) В свою очередь гидроксильная группа влияет на карбонильную группу, поэтому связь С = О в кислотах более прочная, чем в альдегидах.
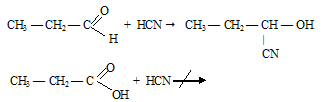
Вопрос 3.
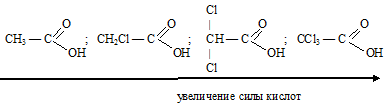
В молекулах хлорпроизводных уксусной кислоты атом хлора в радикале оттягивает на себя электронную плотность, тем самым снижая +I эффект радикала и ослабляя связь О—Н, поэтому хлоропроизводные уксусной кислоты проявляют более сильные кислотные свойства, чем сама уксусная кислота. Чем больше атомов хлора содержится в радикале, тем сильнее выражены кислотные свойства вещества.
Вопрос 4.
Концентрированные азотная и серная кислоты – очень сильные окислители, в роли окислителя выступают не ионы Н+, а нитрат-ионы (NO3–) и сульфат-ионы (SO42–), поэтому логично ожидать, что в результате таких реакций получают другие вещества, а не образуется водород Н2.
Вопрос 5.
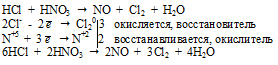
Вопрос 6.
В молекуле HCl связь Г—Н менее прочная, чем в молекуле HF, так как увеличивается длина связи, поэтому соответственно и кислота HCl более сильная, чем HF, но также HF является более слабой кислотой, так как между её молекулами образуются , и атомы водорода одной молекулы HF связаны с атомами фтора другой, а не только между своей молекулой. При этом образуются ассоциаты (HF)n, где n принимает численные значения до 6. Поэтому диссоциация молекул H—F проявляется значительно меньше, чем HCl.
… H—F … H—F … H—F … H—F …
Вопрос 7.
| Сильные кислоты | Средние кислоты | Слабые кислоты |
HCl K  H2SO4 K1 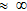 HNO3 K 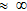 HClO4 K 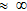 HClO3 K 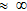 |
H2SO3 K1 = 3 . 10–2 H3PO4 K1 = 7,1 . 10–3 HCOOH K = 1,8 . 10-4 HF K = 6,6 . 10–4 HNO2 K = 4 . 10–4 |
H2S K1 = 6 . 10–8 H2SiO3 K1 = 2,2 . 10–10 HClO K = 5 . 10–8 C6H5OH K = 1 . 10–10 |
Вопрос 8.
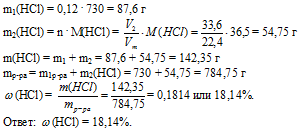
Вопрос 9.