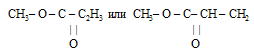Метод определения простейшей формулы эфира
Некоторые задачи в тестах ЕГЭ представляют собой комбинацию двух более простых задач. Рассмотрим такой пример.
Задача 2.8.
При взаимодействии одноатомного спирта, содержащего 37,5% углерода и 50% кислорода, с органической кислотой образуется вещество, плотность паров которого по аргону равна 2,15. Определите молекулярную формулу образующегося вещества.
Дано:
массовая доля углерода в спирте: 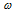 (С)в спирте = 37,5% ;
(С)в спирте = 37,5% ;
массовая доля кислорода в спирте: 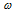 (О)в спирте = 50% ;
(О)в спирте = 50% ;
относительная плотность паров эфира по аргону: D(Аr) = 2,15.
Найти: молекулярную формулу эфира.
Решение:
Данная задача представляет собой комбинацию двух более простых задач. В первой из них требуется узнать формулу спирта по значениям массовых долей элементов в нем. Во второй части требуется выявить формулу эфира по его молярной массе. Рассмотрим ход решения более подробно.
Шаг 1. Очевидно, что при взаимодействии одноатомного спирта с органической кислотой образуется сложный эфир. Если предположить, что в реакции участвовала карбоновая кислота, то в состав образовавшегося сложного эфира входят углерод, водород и кислород.
Шаг 2. Для составления уравнения реакции необходимо определить формулы спирта и кислоты. В условии указано, что спирт был одноатомным, следовательно, в его состав входил лишь один атом кислорода. Соотношение атомов углерода и водорода в углеводородном радикале нам неизвестно. Поэтому формулу спирта обозначим как СxHyOH.
В отношении карбоновой кислоты в условии нет никакой информации, но небольшое значение молярной массы эфира, рассчитанное по относительной плотности его паров позволяет утверждать, что она была одноосновная. Обозначим ее формулу как СzHkCOOH.
Запишем :
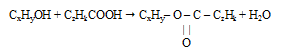
Шаг 3. По значениям массовых долей элементов определим соотношение атомов в молекуле спирта.
Сначала определим массовую долю водорода. Так как в состав спирта входит только углерод, кислород и водород, сумма их массовых долей составит 100% :
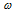 (С) +
(С) + 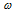 (О) +
(О) + 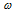 (Н) = 100%
(Н) = 100%
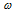 (Н) = 100% –
(Н) = 100% – 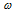 (С) –
(С) – 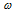 (О) = 100% –37,5% – 50% = 12,5%.
(О) = 100% –37,5% – 50% = 12,5%.
Теперь необходимо произвольно выбрать некоторый образец, в котором мы будем определять соотношение количеств веществ элементов. В условии указана информация о массовой доле, поэтому удобно выбрать образец массой 100 г. В этом случае числовые значения массовой доли каждого элемента совпадут с его массой в этом стограммовом образце.
Итак, в 100 г искомого вещества содержится 37,5 г углерода, 12,5 г водорода и 50 г кислорода.
Далее вычислим соотношение количеств вещества (n) углерода, водорода и кислорода.
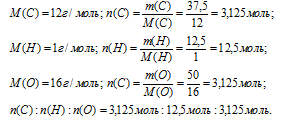
Шаг 4. Находим .
n(С): n(H) : n(О) = 3,125 : 12,5 : 3,125
Выбираем наименьшее значение (в данном случае «3,125») и делим на него все три числа:
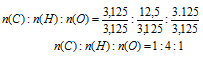
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу: СН4О.
Шаг 5. В условии есть указание на одноатомность спирта. Это значит, что его молекула содержит только один атом кислорода. Следовательно, индексы в простейшей формуле увеличивать не надо, она совпадает с истинной. Запишем спирта, выделив в ней гидроксильную группу: СН3ОН.
с учетом найденной формулы спирта будет иметь следующий вид:
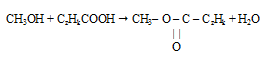
По относительной плотности паров по аргону определяем истинную молярную массу эфира:
М(эфира) = D(Аr) . M(Аr) = 2,15 . 40 = 86 г/моль.
Определим вклад в общую молярную массу углеводородного радикала - остатка от карбоновой кислоты:
М(СzHk) = 86 – (12 + 1 . 3 + 16 . 2 + 12) = 27 г/моль.
По значениям молярных масс элементов составляем математическое уравнение с двумя неизвестными:
12 . z + 1 . k = 27
Пренебрегая вкладом массы водорода в общую массу, получаем математическое уравнение, позволяющее оценить количество атомов углерода в молекуле:
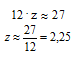
Если количество атомов углерода в углеводородном радикале равно 2, то подставляя z = 2 в математическое уравнение с двумя неизвестными получаем:
12 . 2 + 1 . k = 27
k = 8.
Следовательно, углеводородный радикал оставшейся в молекуле эфира от карбоновой кислоты имеет формулу: С2Н3.
Формула эфира для формирования ответа будет иметь вид: