Термохимические расчеты энтропии, энтальпии и энергии Гиббса
Задача 320.
В каком из следующих случаев реакция неосуществима при любых температурах: а)  H > 0,
H > 0,  > 0; 6)
> 0; 6)  H > 0,
H > 0,  < 0; в)
< 0; в)  H < 0,
H < 0,  <0?
<0?
Решение:
а) При  H > 0,
H > 0, > 0 в уравнении
> 0 в уравнении 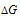 =
=  H - T
H - T второй член равенства (- T
второй член равенства (- T ) будет иметь отрицательное значение, поэтому член (
) будет иметь отрицательное значение, поэтому член (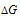 ) примет тоже отрицательное значение только при достаточно большом числовом значении (Т). Член (
) примет тоже отрицательное значение только при достаточно большом числовом значении (Т). Член (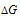 ) может быть отрицателен только при очень высоких значениях температуры (Т). Реакция возможна только при достаточно высоких температурах, потому что с ростом члена (Т) будет наблюдаться уменьшение значения члена (
) может быть отрицателен только при очень высоких значениях температуры (Т). Реакция возможна только при достаточно высоких температурах, потому что с ростом члена (Т) будет наблюдаться уменьшение значения члена ( 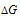 ).
).
б) При  H > 0,
H > 0, < 0 в уравнении
< 0 в уравнении 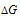 =
=  H - T
H - T второй член равенства (- T
второй член равенства (- T ) будет иметь положительное значение при любых значениях температуры (Т). Так как
) будет иметь положительное значение при любых значениях температуры (Т). Так как  H > 0, то при положительном значении члена (T
H > 0, то при положительном значении члена (T ) значение члена (
) значение члена (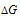 ) будет иметь положительное значение при любых значениях (Т), т.е. реакция невозможна при любых температурах
) будет иметь положительное значение при любых значениях (Т), т.е. реакция невозможна при любых температурах
в) При  H < 0,
H < 0,  < 0, реакция возможна при условии, что член
< 0, реакция возможна при условии, что член  H в уравнении
H в уравнении 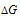 =
=  H - T
H - T больше по абсолютному значению, чем член (T
больше по абсолютному значению, чем член (T ); поскольку абсолютное значение члена (T
); поскольку абсолютное значение члена (T ) с ростом множителя (Т) увеличивается, то указанное условие будет осуществляться при достаточно низких температурах, т.е. при низких температурах наиболее вероятно самопроизвольное протекание , даже если при этом уменьшается.
) с ростом множителя (Т) увеличивается, то указанное условие будет осуществляться при достаточно низких температурах, т.е. при низких температурах наиболее вероятно самопроизвольное протекание , даже если при этом уменьшается.
Ответ: б).
Задача 321.
Если  H < О и
H < О и  < 0, то в каком из случаев реакция может протекать самопроизвольно: а) [
< 0, то в каком из случаев реакция может протекать самопроизвольно: а) [ H ] > [T
H ] > [T ]; б) [
]; б) [  H] < [T
H] < [T ]?
]?
Решение:
При  < 0 в уравнении
< 0 в уравнении 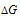 =
=  H - T
H - T второй член равенства (- T
второй член равенства (- T ) будет иметь положительное значение при любых температуры (Т), поэтому реакция возможна при условии, что член (
) будет иметь положительное значение при любых температуры (Т), поэтому реакция возможна при условии, что член ( H) в уравнении (
H) в уравнении (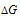 =
=  H - T) больше по абсолютному значению, чем член (T
H - T) больше по абсолютному значению, чем член (T ). Если же в уравнении (
). Если же в уравнении (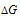 =
=  H - T
H - T ) член (
) член ( H) будет иметь меньше значение, чем член (T
H) будет иметь меньше значение, чем член (T ), то значение члена (
), то значение члена (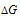 ) всегда будет положительно, значит, реакция невозможна.
) всегда будет положительно, значит, реакция невозможна.
Таким образом, при [ H] > [T
H] > [T ] реакция может протекать самопроизвольно.
] реакция может протекать самопроизвольно.
Ответ: а).
Задача 322.
Исходя из знака 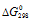 следующих реакций:
следующих реакций:
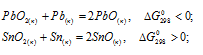
сделать вывод о том, какие степени окисленности более характерны для свинца и олова: а) для свинца +2, для олова +2; 6) для свинца +2, для олова +4; в) для свинца +4, для олова +2; г) для свинца +4, для олова +4.
Решение:
а) Для свинца +2 реакция образования PbO возможна (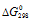 < 0), для олова +2 реакция образованиям SnO невозможна (
< 0), для олова +2 реакция образованиям SnO невозможна (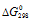 > 0).
> 0).
б) Для свинца +2 реакция образования PbO возможна (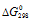 < 0), для олова +4 реакция образованиям SnO2 возможна (
< 0), для олова +4 реакция образованиям SnO2 возможна (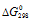 < 0).
< 0).
в) Для свинца +4 реакция образования PbO2 невозможна (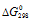 > 0), для олова +4 реакция образованиям SnO2 невозможна (
> 0), для олова +4 реакция образованиям SnO2 невозможна (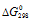 > 0).
> 0).
г) Для свинца +4 реакция образования PbO2 невозможна (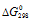 > 0), для олова +4 реакция образованиям SnO2 возможна (
> 0), для олова +4 реакция образованиям SnO2 возможна ( 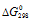 < 0).
< 0).
Вывод: более характерны для свинца и олова степени окисления соответственно +2 и +4, так как реакции образования PbO и SnO2 могут протекать самопроизвольно при стандартных условиях, имеют отрицательное значение (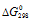 < 0).
< 0).
Ответ: б).
Задача 323.
Каков знак 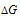 процесса таяния льда при 263 К: а)
процесса таяния льда при 263 К: а) 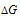 > 0; б)
> 0; б) 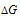 > 0).
> 0).
Решение:
При переходе воды из кристаллического состояния в газообразное система приобретает менее устойчивое состояние, т. е. энтропия её повышается (  > 0). Так как таяние льда процесс эндотермический,
> 0). Так как таяние льда процесс эндотермический,  H > 0.
H > 0.
При  H > 0,
H > 0,  > 0 в уравнении
> 0 в уравнении 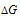 =
=  H - T
H - T второй член равенства (- T
второй член равенства (- T ) будет иметь отрицательное значение, поэтому член ( ) примет тоже отрицательное значение только при достаточно большом числовом значении (Т). Член (
) будет иметь отрицательное значение, поэтому член ( ) примет тоже отрицательное значение только при достаточно большом числовом значении (Т). Член (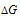 ) может быть отрицателен только при очень высоких значениях температуры (Т). Но так как по условию задачи температура низкая (Т = 263 К), то член (
) может быть отрицателен только при очень высоких значениях температуры (Т). Но так как по условию задачи температура низкая (Т = 263 К), то член (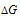 > O), т.е. процесс таяния льда при данной температуре невозможен.
> O), т.е. процесс таяния льда при данной температуре невозможен.
Ответ: а).
Задача 324.
Учитывая, что NO2(г) окрашен, а N2O4(г) бесцветен, и исходя из знака изменения энтропии в реакции 2NO2(г) = N2О4(г), предсказать, как изменится окраска в системе NO2 —N2O4 с ростом температуры: а) усилится; б) ослабеет.
Решение:
В реакции 2NO2(г) = N2О4(г) уменьшается общее число молей, а также число молей газообразных веществ, т.е. система из менее устойчивого состояния переходит в более устойчивое состояние, процесс сопровождается уменьшением энтропии ( < 0). Прямая реакция – , значит
< 0). Прямая реакция – , значит  H < 0. При
H < 0. При  H < 0,
H < 0,  < 0, реакция возможна при условии, что член
< 0, реакция возможна при условии, что член  H в уравнении
H в уравнении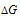 =
=  H - T
H - T больше по абсолютному значению, чем член T
больше по абсолютному значению, чем член T ; поскольку абсолютное значение члена T
; поскольку абсолютное значение члена T с ростом множителя Т увеличивается, то указанное условие будет осуществляться при достаточно низких температурах, т.е. при низких температурах наиболее вероятно самопроизвольное протекание экзотермических реакций (прямой реакции), даже если при этом уменьшается. Но в системе NO2 —N2O4 производят повышение температуры, значит, равновесие сместится в сторону образования NO2, т.е. окраска раствора усилится.
с ростом множителя Т увеличивается, то указанное условие будет осуществляться при достаточно низких температурах, т.е. при низких температурах наиболее вероятно самопроизвольное протекание экзотермических реакций (прямой реакции), даже если при этом уменьшается. Но в системе NO2 —N2O4 производят повышение температуры, значит, равновесие сместится в сторону образования NO2, т.е. окраска раствора усилится.
Ответ: а).

