Рассчеты, связанные с приготовлением растворов
Задача 411.
Сколько граммов 2%-ного (по массе) раствора AgNO3 дадут при взаимодействии с избытком NaCl 14,35 г осадка?
Решение:
М(AgNO3) = 169,888 г/моль;
М(AgCl) = 143,337 г/моль.
Уравнение реакции имеет вид:
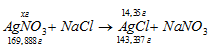
Рассчитаем массу AgNO3, необходимую для получения 14,35 г AgCl из пропорции:
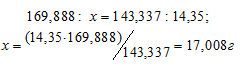
Массу 2%-ного раствора AgNO3 рассчитаем по уравнению:
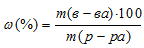 ,
,
где
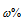 - растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
- растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
Отсюда масса раствора равна:
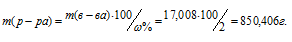
Ответ: 850,406 г.
Задача 412.
Сколько литров NH3 (объем измерен при нормальных условиях) следует растворить в 200 г 10%-ного (по массе) раствора NH4OH, чтобы получить 15%-ный раствор NH4OH?
Решение:
Масса NH4OH в 200г 10%-ного раствора составляет 20 г (200 . 0,1 = 20). Обозначим массу NH4OH, который следует растворить в 200 г 10%-ного раствора NH4OH, чтобы получить 15%-ный раствор его через х.
Для расчёта массы NH4OH используем формулу:
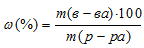
где
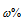 - растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
- растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
Тогда
- m(NH4OH) = 20 + x;
m(NH4OH) = 200 + x;
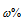 = 15/100 = 0,15.
= 15/100 = 0,15.
Отсюда находим x по формуле:
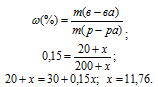
Массу NH3, содержащуюся в11,76 г NH4OH находим из пропорции:
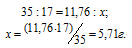
Согласно закону Авогадро 1 моль любого газа при нормальных условиях занимает объём равный 22,4 л. Объём, который занимает NH3 массой 5,71 г, находим из пропорции:
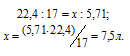
Ответ: 7,5 л.
Задача 413.
Сколько граммов SO3 надо растворить в 400 г Н2О, чтобы получить 15%-ный (по массе) раствор Н2SO4?
Решение:
В молекуле Н2SO4 масса SO3 и Н2SO4 связаны друг с другом соотношением:
M(SO3) = 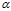 . M(Н2SO4),
. M(Н2SO4),
где
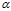 - SO3, M(SO3) = 80 г/моль, M(Н2SO4) = 98 г/моль. Тогда
- SO3, M(SO3) = 80 г/моль, M(Н2SO4) = 98 г/моль. Тогда 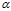 = 80/98 = 0,816.
= 80/98 = 0,816.
Обозначим массу SO3 через х, а массу Н2SO4, соответственно, можно обозначить как x/0,816, массу полученного раствора – как (400 + х).
Для расчета "х" используем формулу:
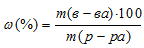 ,
,
где
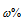 - растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
- растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
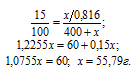
Ответ: 55,79 г.
Задача 414.
Найти массу NaNO3, необходимую для приготовления 300 мл 0,2 М раствора.
Решение:
М(NaNO3) = 85 г/моль. Массу NaNO3, содержащуюся в 0,2 М находим из пропорции:
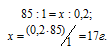
Массу NaNO3, необходимую для приготовления 300 мл 0,2 М раствора находим из пропорции:
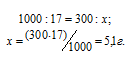
Ответ: 5,1 г.
Задача 415.
Сколько граммов Na2CO3 содержится в 500 мл 0,25 н. раствора?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:
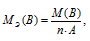
где
MЭ(В) - соли, г/моль; М(В) - молярная масса соли; n - коэффициент при атоме металла; A - валентность металла.
Отсюда
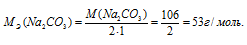
Массу соли Na2CO3, содержащуюся в 500мл 0,25 н раствора, находим по формуле:
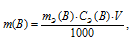
где
m(B) - масса вещества; MЭ(В) - вещества, г; CЭ(В) - эквивалентная концентрация или нормальность; V - объём раствора.
Отсюда
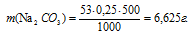
Ответ: 6,625 г.

