Решение задач по хими на вычисление мольной доли вещества в растворе
Задача 427.
Вычислить мольные доли спирта и воды в 96%-ном (по массе) растворе этилового спирта.
Решение:
(Ni) – отношение количества растворённого вещества (или растворителя) к сумме количеств всех веществ, находящихся в растворе. В системе, состоящей из спирта и воды, (N1) равна
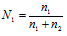 , а спирта
, а спирта 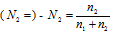 , где n1 - количество спирта; n2 - количество воды.
, где n1 - количество спирта; n2 - количество воды.
Рассчитаем массу спирта и воды, содержащихся в 1 литре раствора, при условии, что их плотности равны единице из пропорций:
а) масса спирта:
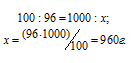
б) масса воды:
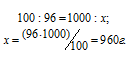
Находим по формуле: 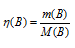 , где m(В) и М(В) – масса и количество вещества.
, где m(В) и М(В) – масса и количество вещества.
Тогда
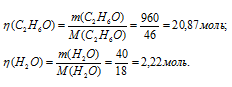
Теперь рассчитаем :
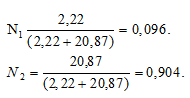
Ответ: 0,904; 0,096.
Задача 428.
В 1 кг воды растворено 666г КОН; плотность раствора равна 1,395 г/мл. Найти: а) массовую долю КОН; б) молярность; в) моляльность; г) мольные доли щелочи и воды.
Решение:
а) – процентное отношение массы растворённого вещества к общей массе раствора определяется по формуле:
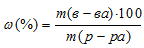
где
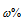 - ; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
- ; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
m(р-ра) = m(H2O) + m(KOH) =
= 1000 + 666 = 1666 г.
Тогда
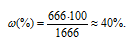
б) показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Найдём массу КОН, приходящуюся на 100 мл раствора по формуле: формуле: m = p V, где p - плотность раствора, V - объём раствора.
Тогда
m(KOH) = 1,395 . 1000 = 1395 г.
Отсюда
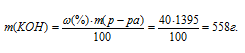
Теперь рассчитаем а:
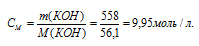
в) (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000 г растворителя.
Находим, сколько граммов HNO3 приходится на 1000 г воды, составив пропорцию:
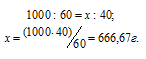
Теперь рассчитаем моляльность раствора:
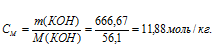
г) (Ni) – отношение количества растворённого вещества (или растворителя) к сумме количеств всех веществ, находящихся в растворе. В системе, состоящей из спирта и воды, (N1) равна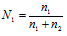 а спирта
а спирта 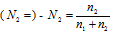 , где n1 - количество щёлочи; n2 - количество воды.
, где n1 - количество щёлочи; n2 - количество воды.
В 100 г данного раствора содержится 40 г КОН и 60 г Н2О.
Откуда
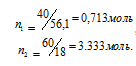
Тогда
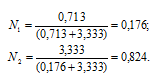
Ответ: а) 40%; б) 9,95 моль/л; в) 11,88 моль/кг; г) 0,176; 0,824.
Задача 429.
Плотность 15%-ного (по массе) раствора H2SO4 равна 1,105 г/мл. Вычислить: а) нормальность; б) молярность; в) моляльность раствора.
Решение:
Найдём массу раствора по формуле: m = p V, где p - плотность раствора, V - объём раствора.
Тогда
m(H2SO4) = 1,105 . 1000 = 1105 г.
Массу H2SO4, содержащуюся в 1000 мл раствора, находим из пропорции:
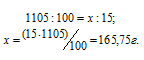
Определим H2SO4 из соотношения:
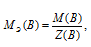 где
где
МЭ(В) - кислоты, г/моль; М(В) - молярная масса кислоты; Z(В) - ; Z(кислоты) равно числу ионов H+ в H2SO4 - 2.
Отсюда
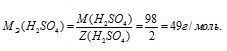
а) а (или нормальность) показывает растворённого вещества, содержащегося в 1 литре раствора.
Тогда
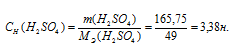
б) (или моляльность) показывает растворённого вещества, содержащихся в 1000 г растворителя.
Теперь рассчитаем моляльность раствора:
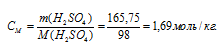
в) показывает растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов H2SO4 содержится в 1000 г воды, составив пропорцию:
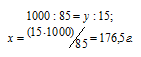
а) Массу , содержащуюся в растворе, вычислим по формуле:
Теперь рассчитаем моляльность раствора:
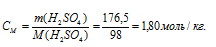
Ответ: а) 3,38н; б) 1,69 моль/л; 1,80 моль/кг.
Задача 430.
Плотность 9%-ного (по массе) раствора сахарозы С12Н22О11 равна 1,035 г/мл. Вычислить: а) концентрацию сахарозы в г/л; б) молярность; в) моляльность раствора.
Решение:
М(С12Н22О11) = 342г/моль. Найдём массу раствора по формуле: m = p V, где p - плотность раствора, V - объём раствора.
Тогда
m(С12Н22О11) =1,035 . 1000 = 1035 г.
а) Массу С12Н22О11, содержащуюся в растворе, вычислим по формуле:
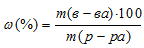
где
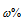 - ; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
- ; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
Тогда
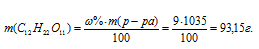
Концентрация вещества в г/л показывает число граммов (единиц массы), содержащихся в 1л раствора. Следовательно, концентрация сахарозы составляет 93,15г/л.
б) (СМ) показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Тогда
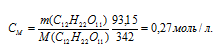
в) (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов С12Н22О11 содержится в 1000 г воды, составив пропорцию:
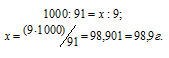
Теперь рассчитаем :
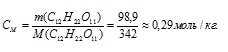
Ответ: а) 93,15 г/л; б) 0,27 моль/л; в) 0,29 моль/кг.

