Какие процессы протекают на электродах при электролизе солей серной кислоты
Задача 711.
При электролизе водного раствора сульфата никеля (II) на аноде протекает процесс: 2H2O → O2 + 4H+ + 2 . Из какого материала сделан анод: а) из никеля; б) из меди; в) из золота?
. Из какого материала сделан анод: а) из никеля; б) из меди; в) из золота?
Решение:
электрохимической системы Ni → Ni2+ + 2 (-0,24 В) положительнее потенциала водородного электрода в нейтральной среде (-0,41 В) незначительно. Поэтому на катоде будет выделяться никель:
(-0,24 В) положительнее потенциала водородного электрода в нейтральной среде (-0,41 В) незначительно. Поэтому на катоде будет выделяться никель:
Ni2+ + 2 = Ni0.
= Ni0.
Так как на аноде протекает процесс: 2H2O → O2 + 4H+ + 2 , то материалом анода служит золото, потому что потенциал окисления воды (+1,228 В) выше, чем потенциал окисления никеля (-0,24 В) и меди (+0,337 В), но несколько ниже, чем для окисления золота (+1,498 В).
, то материалом анода служит золото, потому что потенциал окисления воды (+1,228 В) выше, чем потенциал окисления никеля (-0,24 В) и меди (+0,337 В), но несколько ниже, чем для окисления золота (+1,498 В).
Ответ: в).
Задача 712.
При электролизе водного раствора сульфата калия значение рН раствора в приэлектродном пространстве возросло. К какому полюсу источника тока присоединен электрод: а) к положительному; б) к отрицательному?
Решение:
Поскольку калий в стоит значительно раньше водорода, то у катода будет происходить выделение водорода и накопление ионов OH-, что приводит к повышению рН раствора. У анода будет идти выделение кислорода и накопление ионов H+, что способствует понижению рН раствора. В то же время в катодное пространство будут приходить ионы К+, а в анодное – ионы SO42-. Таким образом, раствор во всех его частях будет оставаться электронейтральным. Однако в катодном пространстве будет накапливаться щёлочь, а в анодном – кислота. Поэтому электрод присоединён к отрицательному полюсу источника тока, т.е. является катодом, на котором протекает восстановление воды:
2Н2О + 2ē = Н2↑ + 2ОН-
Ответ: б)
Задача 713.
При электролизе водного раствора соли значение рН в приэлектродном пространстве одного из электродов возросло. Раствор какой соли подвергся электролизу: а) КСI; б) СuCl2; в) Сu(NO3)2?
Решение:
систем K → K+ + 1 и Cu → Cu2+ + 2
и Cu → Cu2+ + 2 соответственно равны -2,924 В и 0,337 В, то в случае соли KCl у катода будет происходить электрохимическое восстановление воды, сопровождающееся выделением газообразного водорода и ионов OH-, придающих раствору щелочную среду, что и будет приводить к повышению значения рН. На аноде будет происходить окисление воды с выделением газообразного кислорода и ионов водорода, которые будут понижать рН раствора в прианодном пространстве.
соответственно равны -2,924 В и 0,337 В, то в случае соли KCl у катода будет происходить электрохимическое восстановление воды, сопровождающееся выделением газообразного водорода и ионов OH-, придающих раствору щелочную среду, что и будет приводить к повышению значения рН. На аноде будет происходить окисление воды с выделением газообразного кислорода и ионов водорода, которые будут понижать рН раствора в прианодном пространстве.
Уравнения электродных процессов:
К(+): 2|4|2H2O + 2 = H2↑ + 2OH-
= H2↑ + 2OH-
А(-): 1|2|2Н2О - 4ē = О2↑ + 4Н+
В случае СuCl2 и Сu(NO3)2, на катоде будет происходить электрохимическое восстановление ионов меди:
Cu2+ + 2 = Cu0.
= Cu0.
Поэтому при малоактивного металла – меди рН раствора в приэлектродном пространстве не будет повышаться.
Ответ: а).
Задача 714.
При электролизе водного раствора NaOН на аноде выделилось 2,8 л кислорода (условия нормальные). Сколько водорода выделилось на катоде: а) 2,8 л; б) 5,6 л; в) 11,2 л; г) 22,4 л?
Решение:
При едкого натра на электродах выделяется: водород (катод) и кислород (анод). Электрохимические процессы на электродах при NaOH:
катодный процесс: 2H2O + 2 = H2↑+ 2OH-;
= H2↑+ 2OH-;
анодный процесс: 4OH- - 4 = O2 + 2H2O.
= O2 + 2H2O.
Умножи, уравнение катодного процесса на два и сложив его с уравнением анодного процесса, получим суммарное уравнение процесса:
в2H2O = 2H2↑ + O2↑
катод анод
Из суммарного уравнения NaOH вытекает, что при электролизе щёлочи выделяется в два раза большее количество водорода, чем кислорода. Поэтому, если на аноде выделилось 2,8 л кислород, то на катоде в два раза больше выделится водорода: 2,8 . 2 = 5,6 л.
Ответ: б).
Задача 715.
При электролизе раствора CuCl2 масса катода увеличилась на 3,2 г. Что произошло при этом на медном аноде: а) выделилось 0,112 л С12 б) выделилось 0,56 л О2; в) перешло в раствор 0,1 моля Сu2+; г) перешло в раствор 0,05
моля Cu2+?
Решение:
При CuCl2 с медным анодом, последний будет окисляться в ходе электролиза, переходить в раствор в виде катионов Cu2+ и «переосаждаться» на катоде. Следовательно, будет наблюдаться перенос меди с анода на катод. Таким образом, если масса катода увеличилась на 3,2 г, то на аноде такое же количество меди перешло в раствор.
Рассчитаем количество меди: 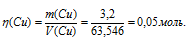
Ответ: г).

