Сравнительная характеристика атомов элементов подгруппы азота
Задача 878.
Дать сравнительную характеристику атомов элементов подгруппы азота, указав: а) электронные конфигурации; б) валентные возможности; в) наиболее характерные степени окисленности.
Решение:
а) Атомы элементов подгруппы азота имеют совпадающие по строению валентные подуровни (ns2np3) различные электронные остовы и вакантные подуровни. Два электрона валентных s-подуровней спарены, три электрона p-подуровней заселяют орбитали этих подуровней по одному. Электронная структура азота выделяется отсутствием вакантных подуровней, энергетически близких к наполовину заполненному 2р-подуровню. У фосфора есть один вакантный 3d-подуровень, а мышьяк, сурьма и висмут имеют несколько вакантных подуровней, близко расположенных к валентным.
б) Атом азота имеет два валентных 2s-электрона и три 2р-электрона, поэтому может проявлять от -3 до +5 (-3, -2, -1, 0, +1, +2, +3, +4, +5). Фосфор, мышьяк, сурьма и висмут имеют одинаковую конфигурацию валентного уровня с атомом азота, но в возбуждённом состоянии их электрон с s-подуровня может занимать вакантную d-орбиталь [ns1hp3(n-1)d1]. Поэтому для этих элементов наиболее характерными являются -3, +3 (атомы находятся в стационарном состоянии) и +5 (атомы находятся в возбуждённом состоянии), исключением является фосфор, который может иметь степень окисления +1.
в) Имея три неспаренных р-электрона атомы элементов подгруппы азота в своём основном состоянии проявляют ковалентность равную 3, а в возбуждённом состоянии, кроме атома азота, равную 5.
Задача 879.
Описать электронное строение NH3, NH4+, N2O, HNO3. Какова азота в каждом из этих соединений?
Решение:
а) Электронная конфигурация валентного слоя атома азота 1s22s22p3. Электронное строение его валентного слоя в стационарном состоянии может быть представлено следующей графической схемой:
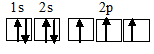
Три неспаренных электрона атома могут участвовать в образовании трёх ковалентных связей по обычному механизму с атомами водорода (1s1), имеющими по одному неспаренному электрону, с образованием молекулы NH3. Электронная формула аммиака имеет вид:
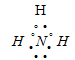
В молекуле аммиака азот имеет свободную электронную пару. азота -3.
б) Связывающая электронная пара атома азота  способна с ионом водорода, имеющим свободную атомную орбиталь
способна с ионом водорода, имеющим свободную атомную орбиталь 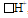 , образовывать ковалентную связь по донорно-акцепторному механизму. Так образуется катион аммония NH4+ из молекулы аммиака и иона водорода:
, образовывать ковалентную связь по донорно-акцепторному механизму. Так образуется катион аммония NH4+ из молекулы аммиака и иона водорода:
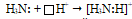
В результате образования несвязывающая электронная пара атома азота становится связывающей, образуется четыре связи между одним атомом азота и четырьмя атомами водорода:
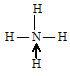
Все четыре связи равнозначны и по длине, и по энергии. азота +4.
в) Молекула N2O имеет электронное строение, которое рассматривается как резонансный гибрид двух асимметричных форм, обладающих линейной структурой:
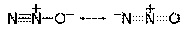
Центральный атом азота имеет две sр-гибридные орбитали. Молекула N2О обладает небольшим дипольным моментом, поэтому оксид диазота умеренно растворим в воде. азота +1.
г) Молекула HNO3 с позиций метода валентных связей имеет следующее строение:
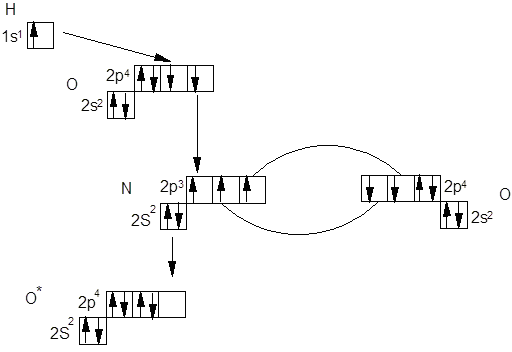
В молекуле HNO3 атом азота с одним атомом кислорода образует двойную связь за счет двух неспаренными электронов азота и кислорода, со вторым атомом кислорода азот образует одну связь за счет третьего неспаренного электрона азота и одного неспаренного электрона атома кислорода, а с третьим атомом кислорода азот образует связь за счет неподеленной электронной пары и свободной р-ячейки атома кислорода, образованной в результате объединения двух неспаренных электронов. Второй атом кислорода образует связь с атомом водорода за счет оставшегося неспаренного электрона и свободного электрона атома водорода. Однако современные методы исследования показали, что строение кислоты таково:
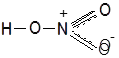
Отсюда видно, что молекула азотной кислоты имеет делокализованные связи. азота +5.

