Характеристика свойств соединений азота
Задача 887.
Какой объем аммиака (условия нормальные) можно получить, подействовав двумя литрами 0,5 н. раствора щелочи на соль аммония?
Решение:
При действии на соли аммония щёлочью получается аммиака:
η(щёлочь) = (NH3)
Находим количество щёлочи, пошедшее на реакцию с солью аммония, получим:
1 : 0,5 = 2 : х;
х = (0,5 . 2)/1= 1 моль.
1 моль любого газа при нормальных условиях занимает объём равный 22,4 л.
Отсюда находим, что объём аммиака, выделившегося при реакции, равен:
V(NH3) = VЭ . (NH3) =
= 22,4 . 1 = 22,4 л.
Ответ: 22,4 л.
Задача 888.
Можно ли в качестве осушителей газообразного аммиака применять Н2SO4 или Р2О5? Ответ мотивировать.
Решение:
Н2SO4 и Р2О5 очень энергично взаимодействуют с водой, серная кислота с образованием кристаллогидратов, а оксид фосфора (V) – с образованием ортофосфорной кислоты Н3РО4:
а) Н2SO4 + Н2О = Н2SO4 . Н2О;
б) Р2О5 +3Н2О = 2Н3РО4.
Поэтому они являются осушителями газовых смесей. В обоих случаях образуются кислоты, с которыми взаимодействует аммиак, образуя соответствующие соли:
2NH3 + Н2SO4 = (NH4)2SO4;
3NH3 + H3PO4 = (NH4)3PO4.
Таким образом, Н2SO4 и Р2О5 нельзя применять в качестве осушителя аммиака, так как при этом происходит химическое взаимодействие аммиака с серной и фосфорной кислотами.
Ответ: Нет, нельзя.
Задача 889.
Написать уравнения реакций термического разложения следующих солей: (NH4)2CO3, NH4NO3, (NH4)2SO4, NH4С1, (NH4)2HPO4, (NH4)H2PO4, (NH4)2Cr2O7, NH4NO2.
Решение:
а) (NH4)2CO3  2NH3↑ + CO2↑ + H2O;
2NH3↑ + CO2↑ + H2O;
б) NH4NO3  N2O↑+ 2H2O
N2O↑+ 2H2O
или
2NH4NO3 2N2↑ + O2↑ + 4H2O;
2N2↑ + O2↑ + 4H2O;
в) (NH4)2SO4  2NH3↑ + H2SO4;
2NH3↑ + H2SO4;
г) NH4С1 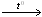 NH3↑ + HCl;
NH3↑ + HCl;
д) (NH4)2HPO4 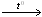 2NH3↑ + H3PO4;
2NH3↑ + H3PO4;
е) (NH4)H2PO4 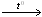 NH3↑ + H3PO4;
NH3↑ + H3PO4;
ж) (NH4)2Cr2O7 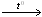 2NH3↑ + 2CrO3↓ + H2O;
2NH3↑ + 2CrO3↓ + H2O;
з) NH4NO2 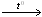 N2↑ + 2H2O.
N2↑ + 2H2O.
Задача 890.
Нитрат аммония может разлагаться двумя путями:
NH4NO3(к) 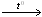 N2O(г) + 2H2O(г);
N2O(г) + 2H2O(г);
NH4NO3(к) 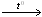 N2(г) + 1/2O2(г) + 2H2O(г).
N2(г) + 1/2O2(г) + 2H2O(г).
Какая из приведенных реакций наиболее вероятна и какая более экзотермичная при 25 °С? Ответ подтвердить расчетом ΔG0298 и ΔH0298. Как изменится вероятность протекания этих реакций при повышении температур?
Решение:
а) Уравнение реакции имеет вид:
NH4NO3(к) 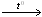 N2O(г) + 2H2O(г)
N2O(г) + 2H2O(г)
Находим ΔH10 реакции, учитывая закон Гесса, получим:
ΔH10 =
= 2ΔH0(Н2О) + ΔH0(N2O) - ΔH0(NH4NO3) =
= 2(-241,8) + 82,0 – (-365,4) =
= -36,2кДж.
Находим реакции, получим:
ΔG10 =
= 2ΔG0(Н2О) + ΔG0(N2O) - ΔG0(NH4NO3) =
= 2(-228,6) + 104,1 – (-183,8) =
= -169,3 кДж.
б) Уравнение реакции имеет вид:
NH4NO3(к)  N2(г) + 1/2O2(г) + 4H2O(г).
N2(г) + 1/2O2(г) + 4H2O(г).
Находим реакции, учитывая , получим:
ΔH20 =
= 2ΔH0(Н2О) + ΔH0(N2) + 1/2ΔH0(О2) - ΔH0(NH4NO3) =
= 2(-241,8) – (-365,4) = -118,2кДж.
Находим реакции, получим:
ΔG20 =
= 2ΔG0(Н2О) + ΔG0(N2O) - ΔG0(NH4NO3) =
= 2(-228,6) – (-183,8) = -273,4 кДж.
ΔH20 < ΔH10 и ΔG20 < ΔG10, поэтому вторая реакция, реакция (б) наиболее вероятна при 25 0С и более зкзотермична, чем реакция (а). Так как обе реакции экзотермичны, то, согласно , при повышении температуры равновесие обеих реакций сместится влево. Вероятность протекания реакции(б), как наиболее экзотермичной, значительно уменьшится при повышении температуры, чем реакции (а).

