Характеристика элементов главной и побочной подгрупп I группы
Задача 970.
Как и почему изменяются основные свойства в ряду LiOH — CsOH?
Решение:
В ряду LiOH — CsOH основные свойства увеличиваются (сила оснований возрастает). Объясняется это тем, что с возрастанием порядкового номера элемента увеличивается радиус иона щелочного металла, что приводит к ослаблению связей Э — О. С ростом заряда ядра атома увеличивается полярность связи. Всё это приводит к тому, что характер диссоциации гидроксидов ЭОН может протекать только по связи Э — О, а не О — Н. При чём будет возрастать в ряду LiOH — CsOH:
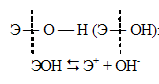
Задача 971.
Чем объясняются различия в свойствах элементов главной и побочной подгрупп I группы?
Решение:
Во внешнем электронном слое атомы элементов главной и побочной подгруппы I группы имеют по одному электрону; но предпоследний электронный слой у атомов главной подгруппы содержится восемь (у лития два) электронов, а у атомов побочной подгруппы - восемнадцать электронов. Структуру двух внешних электронных оболочек атомов элементов главной подгруппы можно изобразить формулой (n-1)s2(n-1)p6ns1, а для элементов побочной подгруппы - (n-1)s2(n-1)p6(n-1)d10ns1, где n – номер периода, в котором расположен данный элемент. Все элементы подгруппы лития относятся к s-элементам, а элементы подгруппы меди – предпоследние члены декад d-элементов. Элементы группы меди, имея большие эффективные заряды и малые радиусы по сравнению с элементами главной подгруппы обладают большей плотностью, высокой температурой плавления и большей величиной энтальпии атомизации; меньшие по размеру атомы располагаются в кристаллической решётке более плотно, вследствие чего силы притяжения между ними велики. Малый радиус атомов также объясняет более высокие значения энергии ионизации металлов этой подгруппы, чем щелочных металлов. Это приводит к большим различиям в химических свойствах металлов обеих подгрупп. Элементы побочной подгруппы – малоактивные металлы. Они с трудом окисляются и, наоборот, их ионы легко восстанавливаются; они не разлагают воду, гидроксиды их являются относительно слабыми основаниями. В элементы подгруппы меди стоят после водорода, а элементы подгруппы лития – до водорода. В то же время восемнадцатиэлектронный слой, устойчивый у других элементов, здесь ещё не вполне стабилизировался и способен к частичной потере электронов. Так, медь наряду с однозарядными ионами образует и двузарядные, которые для неё даже более характерны. Точно так же для золота степень окисления +3 более характерна, чем +1. серебра в его обычных соединениях равна +1; однако известны и соединения серебра со степенью окисления +2 и +3. Все соединения подгруппы лития в своих соединениях имеют +1, а в ряду напряжения стоят до водорода.
Задача 972.
Почему радиус иона Сu+ меньше радиуса иона К+? Какой из этих ионов обладает большей поляризующей способностью?
Решение:
Во внешнем электронном слое атомы элементов главной и побочной подгруппы I группы имеют по одному электрону; но предпоследний электронный слой у атомов главной подгруппы содержит восемь (у лития два) электронов, а у атомов побочной подгруппы - восемнадцать электронов. Структуру двух внешних электронных оболочек атомов элементов главной подгруппы можно изобразить формулой (n-1)s2(n-1)p6ns1, а для элементов побочной подгруппы - (n-1)s2(n-1)p6(n-1)d10ns1, где n – номер периода, в котором расположен данный элемент. Атомы калия и меди содержат одинаковое число электронных слоев (4 слоя), но разное число электронов и разный заряд ядер атомов. Заряд ядра атома калия +19, заряд ядра атома меди +29. С увеличением Z проявляется тенденция к уменьшению размеров атома и иона, так как растущий заряд ядра ведёт к более сильному притяжению электронов к ядру, не компенсируемому взаимным отталкиванием электронов.
Атомы калия и меди содержат по одному электрону на внешнем электронном слое, поэтому они легко отдают его и превращаются в однозарядные ионы К+ и Cu+.
При одинаковых зарядах и К+ и Сu+ различие в их поляризующем действии определяется особенностями их электронного строения. Ион Сu+ имеет 18-электронную внешнюю оболочку – 3s23p63d10 и сравнительно небольшой радиус (0,98 A0), обладает более сильным поляризующим действием, чем ион К+ с благородногазовой электронной структурой – 3s23p6, а его радиус составляет (1,3 3 A0); поэтому он оказывает более слабое поляризующее действие.
Таким образом, при одном и том же заряде катионов:
- поляризуемость ионов с 18-электронной оболочкой (Сu+) выше, чем ионов с благородногазовой электронной структурой(К+);
- поляризационный эффект тем выше, чем меньше радиус катиона;
- поляризационный эффект тем выше, чем больше положительный заряд катиона.

