Химические свойства концентрированной азотной кислоты
Реакции азотной кислоты
Задача 999.
С какими из перечисленных веществ взаимодействует концентрированная НNO3: а) NаОН; 6) СuО; в) Аg; г) КСI? При этом азотная кислота проявляет: 1) кислотные свойства; 2) окислительные свойства.
Решение:
а) Между концентрированной азотной кислотой и гидроксидом натрия произойдёт реакция нейтрализации:
HNO3 (конц.) + NaOH ↔ NaNO3 + H2O
Здесь азотная кислота проявляет свойства кислоты.
б) Между концентрированной азотной кислотой и оксидом меди (II) произойдёт реакция:
2HNO3 (конц.) + CuO ↔ Cu(NO3)2 + H2O
Здесь азотная кислота проявляет свойства кислоты.
в) Между концентрированной азотной кислотой и серебром произойдёт окислительно-восстановительная реакция:
Ag + 2HNO3 (конц.) ↔ AgNO3 + NO2↑ + H2O
Здесь азотная кислота проявляет окислительные свойства.
г) При слиянии растворов концентрированной кислоты и хлорида калия реакция не произой2дёт, потому что, находящиеся в растворе ионы К+ и Cl− (KCl ↔ K+ + Cl−), а также ионы Н+ и NO3− (HNO3 ↔ H+ + NO3−) не будут связываться друг с другом с образованием осадка, газа или слабого электролита.
Ответ: а1); б1); в2).
Изомолярные растворы солей
Задача 1000.
Каково соотношение рН изомолярных растворов NаНSО3 (рH1) и Na2SO3 (рH2): а) рH1 > рH2; б) рH1 = рН2; в) рН1 < рН2?
Решение:
KD1(H2SO3) = 1,58 . 10-2;
KD2(H2SO3) = 6,31 . 10-8
NаНSОз – кислая соль слабой кислоты и сильного основания гидролизуется по аниону:
NаНSО3 ↔ Na+ + HSO3−;
HSO3− + H2O ↔ H2SO3 + OH−
Na2SO3 – соль слабой кислоты и сильного основания гидролизуется по аниону:
Na2SO3 ↔ 2Na+ + SO32-;
I ступень: SO32- + H2O ↔ HSO3− +OH−;
II ступень: HSO3− + H2O ↔ H2SO3 + OH−.
а определяется по формуле:
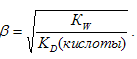
Так как Na2SO3 практически гидролизуется по первой ступени, то то этой соли будет определяться второй константой диссоциации H2SO3, а соли NаНSО3 – первой константой диссоциации H2SO3. Поэтому соли Na2SO3 будет больше, чем константа гидролиза соли NаНSО3. Следовательно, соли NаНSО3 будет меньше, чем соли Na2SO3 и, соответственно, концентрация ионов OH− в растворе соли NаНSО3 будет значительно меньше, чем в растворе соли Na2SO3, значит рН1 < pH2.
Ответ: в).

