Восстановительные способности и электроотрицательности атомов в периодической системе элементов
Величина, характеризующая восстановительную способность атомов
Задача 111.
Какая величина количественно характеризует восстановительную способность атомов? Изменение этой величины в пределах периода и в пределах главной и побочной подгрупп.
Решение:
Периодическая система Д.И. Менделеева – это наглядное графическое изображение периодического закона. Наиболее распространена её так называемая короткопериодная форма. В структуре таблицы (системы) выделяют периоды, группы и подгруппы. Так как движение электрона в атоме не имеет строгой, боровской траектории, а носит волновой характер, то и размер атома не имеет строго определенной границы. За радиус атома обычно принимают теоретически рассчитанные положения максимума плотности внешнего электронного облака. Такие радиусы называют орбитальными. Практически используют эффективные радиусы, которые определены из строения молекул и кристаллов. Радиусы атомов являются одной из важных характеристик элементов, т.к. размеры атомов определяют ряд физико–химических показателей и химическую активность элементов. Изменение атомных радиусов элементов носит периодический характер. Рассмотрим, как меняют радиуса атомов в пределах одного периода и одной группы. Если в химических реакциях элемент отдает электроны и повышает степень окисления, то он проявляет восстановительные свойства. Наоборот, в случае присоединения элементом электронов и понижении степени окисления, элемент проявляет окислительные свойства. Восстановительные и окислительные свойства элементов зависят от радиусов атомов. Чем меньше радиус атома, тем труднее элемент отдает электроны и слабее проявляет восстановительные свойства. В этом случае у элемента активнее будут проявляться окислительные свойства. В периодах слева направо восстановительные свойства элементов уменьшается, а окислительные – увеличиваются. В группах сверху вниз увеличиваются восстановительные свойства и уменьшаются окислительные.
Электроотрицательность элементов
Задача 112.
Понятие об электроотрицательности. Изменение величины электроотрицательности в пределах периода и в пределах главной и побочной подгрупп.
Решение:
Электpоoтрицательность ("Х") - способность атома удерживать внешние электроны, т.е. способность атома, связанного с другим атомом, притягивать к себе связующее электронное облако, вызывая тем самым поляризацию ковалентной связи. Она определяется степенью притяжения этих электронов к положительно заряженному ядру.
Это свойство проявляется в химических связях как смещение электронов связи в сторону более электроотрицательного атома.
Электpоотрицательность атомов, участвующих в образовании химической связи, - один из главных факторов, который определяет не только тип химической связи, но и свойства этой связи, и тем самым влияет на характер взаимодействия между атомами при протекании химической реакции.
Электроотрицательнось по Полингу – это свойство атомов, связанных химическими связями, т.е. находящихся в составе химических соединений.Электроотрицательность не является абсолютной константой элемента. Она зависит от эффективного заряда ядра атома, который может изменяться под влиянием соседних атомов или групп атомов.
В шкале относительных электроотрицательностей элементов Л.Полинга (рассчитанных на основании зависимости энергий связей от различий в электроотрицательностях ((ΔX)) связываемых атомов) металлы и элементы-органогены приведены в таблице (Рис.1.):
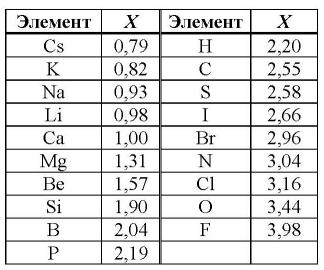
Рис. 1.Электроотрицательности (X) некоторых элементов.
Данные из справочника: CRS Handbook of Chemistry and Physics (издание 2007 года).
Электроотрицательность элементов возрастает по периоду и несколько убывает в группах с возрастанием номера периода у элементов I, II, V, VI и VII главных подгрупп, III, IV и V – побочных подгрупп, имеет сложную зависимость у элементов III главной подгруппы (минимум "X" у Al), возрастает с увеличением номера периода у элементов VII-VIII побочных подгрупп. Наименьшие значения "X" имеют s-элементы I подгруппы, наибольшие – p-элементы VII и VI групп.
Примеры электронной формулы р-элементов:
Алюминий Аl 1s2 2s2 2p6 3s2 3p1;
Азот N 1s2 2s2 2p3.

