Определение степени ионности связей, направления смещения электронной пары в молекуле вещества
Задача 228.
Энергия ионизации атомов фтора и хлора составляет соответственно 17,4 и 13,0 эВ, а энергия сродства к электрону 3,45 и 3,61 эВ. для какого из этих элементов более характерно образование ионных соединений? Указать знак заряда ионов галогенов в этих соединениях.
Решение:
Энергия ионизации – это энергия, которую необходимо затратить для удаления электрона из изолированного, свободного атома, находящегося в основном состоянии, на бесконечно большое расстояние.
– это энергия, которая выделяется в результате присоединения электрона электроотрицательным атомом и превращения его в анион.
Таким образом, фтор, обладая большей , чем хлор, способен сильнее удерживать неспаренный электрон, т.е. проявляет в большей степени неметаллические свойства. Фтор обладает самой высокой электроотрицательностью из всех химических элементов, поэтому обладает более выраженной способностью к образованию ионных соединений, чем хлор.
Обладая меньшей энергией сродства к электрону фтор в большей степени, чем хлор, способен образовывать ионы.
атомов фтора и хлора может быть представлена формулой ns2np5, т.е на внешнем валентном слое их атомы содержат по семь электронов и, присоединяя недостающий восьмой электрон, превращаются в однозарядные анионы F- и Cl-, которые имеют устойчивую электронную конфигурацию благородного газа аргона.
Таким образом, для фтора более характерно образование , чем для хлора. Фтор и хлор образуют ионы знак заряда, которых -1.
Задача 229.
Указать тип химической связи в молекулах Н2, С12, НСI. Привести схему перекрывания электронных облаков.
Решение:
В молекулах Н2 и Cl2 наблюдается , а в HCl – .
образуется двумя электронами от двух разных атомов, причём электроны с противоположно направленными спинами. Эта электронная пара принадлежит одновременно двум атомам. Комбинации таких двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем. Например:
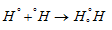
Схемы перекрывания электронных облаков имеют вид:
а) Для Н2 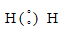 .
.
Общая электронная пара расположена на одинаковом расстоянии от центров обоих атомов водорода – .
б) Для Cl2 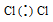
Общая электронная пара расположена на одинаковом расстоянии от центров обоих атомов хлора – связь .
в) Для HCl 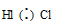
Общая электронная пара атомов водорода и хлора смещена в сторону более хлора – связь ковалентная полярная.
Во всех случаях перекрывание атомных орбиталей происходит на межъядерной оси, т.е. образуются  -связи (сигма-связь).
-связи (сигма-связь).
В молекулах Н2 и Cl2 электронная пара расположена на одинаковом расстоянии от атомных ядер, потому что в молекулах простых веществ Н2 и Cl2 одинаковая, связь . В молекуле HCl электронная пара смещена в сторону более электроотрицательного атома Cl ( Cl равна 2,9, а Н – 2,16), связь , образующаяся между разными атомами.
Задача: 230.
Пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей К — С1, Са — С1, Fе — С1, Gе — С1. Какая из связей характеризуется наибольшей степенью ионности?
Решение:
По данным таблицы «» вычисляем разность электроотрицательностей для связей:
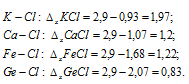
Наибольшей характеризуется связь K—Cl. Таким образом, связь K—Cl характеризуется наибольшей ионностью, так как она более полярная. Диссоциация по связи K—Cl в водных растворах будет проходить легче, чем во всех других случаях, при этом образуются ионы:
KCl ⇔ K+ + Cl-
Задача 231.
Какой характер имеют связи в молекулах NCl3, СS2, JCl5, NF3, OF2, ClF, СО2? Указать для каждой из них направление смещения общей электронной пары.
Решение:
а) При соединении атома азота с тремя атомами хлора образуется молекула NCl3, в которой каждый из трёх атомов хлора связан с атомом азота парой общих электронов (один электрон от атома хлора, другой – от атома азота). Схема молекулы NCl3 имеет вид:
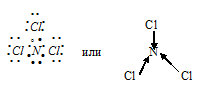
N—C равна 0,26 (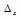 = 3,16 – 2,9 = 0,26), т. е. имеет незначительное численное значение, значит, связь ковалентная слабополярная (
= 3,16 – 2,9 = 0,26), т. е. имеет незначительное численное значение, значит, связь ковалентная слабополярная (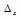 <1). Так как азот более электроотрицательнее (3,16), чем хлор (2,9), то направление смещения общей электронной пары будет в сторону атома азота. Связь слабополярная, характеризуется небольшой степенью ионности.
<1). Так как азот более электроотрицательнее (3,16), чем хлор (2,9), то направление смещения общей электронной пары будет в сторону атома азота. Связь слабополярная, характеризуется небольшой степенью ионности.
б) При соединении атома углерода с двумя атомами серы образуется молекула СS2, в которой каждый из двух атомов серы связан с атомом углерода двумя парами электронов (два электрона от атома серы и два других от атома углерода). СS2 имеет вид:
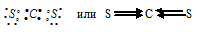
Атом углерода имеет на внешнем электронном слое четыре sp3-гибридных электронных облака, которые перекрываются с электронными облаками четырёх p-электронов атомов серы (по два неспаренных электрона от каждого атома серы). Так как атом углерода более электроотрицательней (2,57), чем атом серы (2,5), то направление смещения общей электронной пары будет в сторону атома углерода. Разность электроотрицательностей связи С—S равна 0,07 (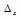 = 2,57 – 2,5 = 0,07). Связь малополярная, характеризуется ничтожно малой с (
= 2,57 – 2,5 = 0,07). Связь малополярная, характеризуется ничтожно малой с (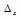 <1).
<1).
в) При соединении атома йода с пятью атомами хлора образуется молекула JCl5, в которой каждый из пяти атомов хлора связан с атомом йода парой общих электронов (один электрон от атома хлора, другой – от йода). Схема строения молекулы JCl5:
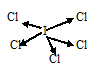
J—Cl равна 0,62 (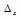 = 2,9 – 2, 28 = 0,62), значит, связь ковалентная полярная, в которой наблюдается смещение электронной пары в сторону более электроотрицательного атома хлора. Связь слабополярная, характеризуется небольшой степенью ионности
= 2,9 – 2, 28 = 0,62), значит, связь ковалентная полярная, в которой наблюдается смещение электронной пары в сторону более электроотрицательного атома хлора. Связь слабополярная, характеризуется небольшой степенью ионности
(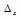 <1).
<1).
г) При соединении атома азота с тремя атомами фтора образуется молекула NF3, в которой каждый из трёх атомов фтора связан с атомом азота парой общих электронов (один электрон от атома фтора, другой – от азота). NF3:
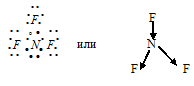
N—F равна 1,04 (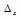 = 4,2 – 3,16 = 1,04). Связь N—F сильно полярна, т.е. характеризуется большой степенью ионности (
= 4,2 – 3,16 = 1,04). Связь N—F сильно полярна, т.е. характеризуется большой степенью ионности (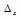 >1). Смещение электронной пары связи N—F будет в сторону более электроотрицательного атома – фтору.
>1). Смещение электронной пары связи N—F будет в сторону более электроотрицательного атома – фтору.
д) При соединении атома кислорода с двумя атомами фтора образуется молекула OF2, в которой каждый из атомов фтора соединён с атомом кислорода парой общих электронов (один от атома фтора, другой – от кислорода). Электронная схема строения молекулы OF2:
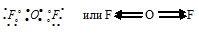
F—O равна 0,6 (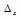 = 4,2 – 3,6 = 0,6), т. е. является , так как
= 4,2 – 3,6 = 0,6), т. е. является , так как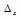 меньше единицы. Смещение электронной пары связи F—O будет в сторону более – фтору.
меньше единицы. Смещение электронной пары связи F—O будет в сторону более – фтору.
е) При соединении атома фтора с атомом хлора образуется молекула ClF, в которой атом фтора соединён с атомом хлора электронной парой за счёт одного электрона от атома фтора, другого – от атома хлора. ClF:
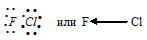
Разность электроотрицательностей связи F—Cl равна 1,3 (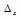 = 4,2 – 2,9 = 1,3), т. е. имеет большое численное значение, что указывает на большую степень ионности. Связь сильнополярная. Смещение электронной пары связи F—Cl будет в сторону более электроотрицательного атома – фтору.
= 4,2 – 2,9 = 1,3), т. е. имеет большое численное значение, что указывает на большую степень ионности. Связь сильнополярная. Смещение электронной пары связи F—Cl будет в сторону более электроотрицательного атома – фтору.
ж) При соединении атома углерода с двумя атомами кислорода образуется молекула СО2, в которой каждый из двух атомов кислорода связан с атомом углерода двумя парами электронов (два электрона от атома кислорода, другие два – от углерода). СО2:
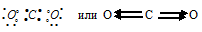
С—О равна 0,5 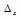 = 3,6 – 2,9 = 0,5), т. е. имеет небольшое численное значение, что указывает на слабую степень ионности. Связь слабополярная. Смещение электронной пары связи С—О будет в сторону более электроотрицательного атома – кислороду.
= 3,6 – 2,9 = 0,5), т. е. имеет небольшое численное значение, что указывает на слабую степень ионности. Связь слабополярная. Смещение электронной пары связи С—О будет в сторону более электроотрицательного атома – кислороду.

