Термохимические расчеты химической реакции. Энергия Гиббса
Задача 369.
Считая, что  и
и 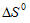 реакции 4НСl(г) + O2(г) ⇔ 2H2O(г) + 2Cl2(г) не зависят от температуры, найти температуру, при которой константа равновесия этой реакции равна единице.
реакции 4НСl(г) + O2(г) ⇔ 2H2O(г) + 2Cl2(г) не зависят от температуры, найти температуру, при которой константа равновесия этой реакции равна единице.
Решение:
Уравнение реакции имеет вид: 4НСl(г) + O2(г) ⇔ 2H2O(г) + 2Cl2(г).
Из уравнения 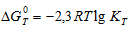 следует, что при kT = - 1 химической реакции равна нулю. Тогда из соотношения
следует, что при kT = - 1 химической реакции равна нулю. Тогда из соотношения 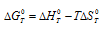 вытекает, что при
вытекает, что при 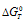 = 0, получим: 0 =
= 0, получим: 0 = 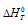 -T
-T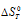 или
или 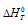 = T
= T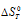 , откуда
, откуда 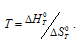
Согласно условию задачи можно пренебречь зависимостью  и
и 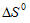 от температуры и для расчётов использовать . Стандартные значения
от температуры и для расчётов использовать . Стандартные значения 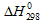 и
и  298 реагирующих веществ равны:
298 реагирующих веществ равны:
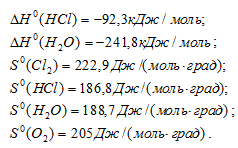
простых веществ принято считать равными нулю. Находим  реакции, используя следствие из закона Гесса:
реакции, используя следствие из закона Гесса:
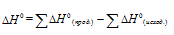
Тогда
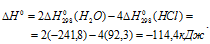
Находим  реакции:
реакции:
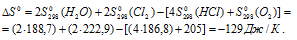
Отсюда
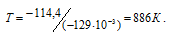
Ответ: 886 К.
Задача 370.
Стандартное изменение энергии Гиббса для реакции А + В ⇔ АВ при 298 К равно -8 кДж/моль. Начальные концентрации [А]0 [В]0 = 1 моль/л. Найти константу равновесия реакции и равновесные концентрации веществ А, В и АВ.
Решение:
Уравнение реакции имеет вид:
А + В ⇔ АВ
при стандартных условиях можно рассчитать, используя соотношение 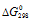 = -5,69lgk298, получим:
= -5,69lgk298, получим:
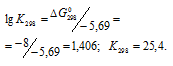
Согласно уравнению реакции из 1 моля вещества А и 1 моля вещества В получается 1 моль вещества АВ. Обозначим количество вещества АВ, полученного при реакции за моль/л. Тогда равновесные концентрации реагирующих веществ будут равны: [А] = (1 – х) моль/л; [В] = (1 – х) моль/л; [АВ] = моль/л.
Используя выражение для данной реакции, рассчитаем значение , получим:
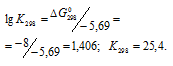
Таким образом, будут равны:
[А] = [В] = 1 – 0,78 = 0,22 моль/л;
[АВ] = x = 0,78 моль/л.
Ответ: К = 25,4; [А] = [В] = 0,22 моль/л; [АВ] = 0,78 моль/л.
Задача 371.
Почему во многих случаях реакция практически не протекает, хотя 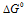 реакций отрицательно? Какими способами можно в подобных случаях добиться протекания реакции?
реакций отрицательно? Какими способами можно в подобных случаях добиться протекания реакции?
Решение:
Следует подчеркнуть, что отрицательный знак 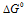 реакции указывает только на возможность протекания этой реакции при стандартных условиях, когда все реагирующие вещества находятся при стандартных условиях (Т=298 К и Р=101,325 кПа). Если же условия изменить, например, активизировать процесс нагреванием, то реакция может начаться. Так, для реакции окисления графита C(рафит) + О2(г) ⇔ СО2(г) имеет отрицательное значение
реакции указывает только на возможность протекания этой реакции при стандартных условиях, когда все реагирующие вещества находятся при стандартных условиях (Т=298 К и Р=101,325 кПа). Если же условия изменить, например, активизировать процесс нагреванием, то реакция может начаться. Так, для реакции окисления графита C(рафит) + О2(г) ⇔ СО2(г) имеет отрицательное значение 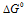 = -394,34 кДж). Однако при обычных условиях не взаимодействуют с кислородом ни графит карандаша, ни каменный уголь, который состоит, главным образом, из углерода в этой . Реакции горения углеводорода (бензин, мазут, природный газ) тоже имеют отрицательное значение реакции и в обычных условиях не протекают, но стоит только их активизировать подогреванием, как начинается реакция горения этих веществ, сопровождающиеся выделением большого количества теплоты. Все эти реакции протекают с переходом системы из более устойчивого состояния в менее устойчивое, при этом,
= -394,34 кДж). Однако при обычных условиях не взаимодействуют с кислородом ни графит карандаша, ни каменный уголь, который состоит, главным образом, из углерода в этой . Реакции горения углеводорода (бензин, мазут, природный газ) тоже имеют отрицательное значение реакции и в обычных условиях не протекают, но стоит только их активизировать подогреванием, как начинается реакция горения этих веществ, сопровождающиеся выделением большого количества теплоты. Все эти реакции протекают с переходом системы из более устойчивого состояния в менее устойчивое, при этом, 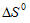 > 0.
> 0.
Таким образом при обычных условиях многие реакции, имеющие отрицательное значение не протекают, потому что их скорости бесконечно малы. При повышении температуры происходит дополнительное образование активных молекул, которые значительно увеличивают скорость протекания данных реакций.
Для некоторых реакций достаточно ввести в систему и реакция начинает протекать, для других – нужно подействовать светом или давлением – все это приводит к дополнительному образованию активных частиц в реакционной системе.
Задача 372.
Для реакции А2(г) + В2(г) ⇔ 2АВ(г) значение 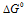 в некотором интервале температур положительно. Означает ли это, что вещество АВ не может быть получено в этом интервале температур прямым взаимодействием А2 и В2? Ответ обосновать.
в некотором интервале температур положительно. Означает ли это, что вещество АВ не может быть получено в этом интервале температур прямым взаимодействием А2 и В2? Ответ обосновать.
Решение:
Уравнение реакции имеет вид: А2(г) + В2(г) ⇔ 2АВ(г).
Из уравнения реакции следует, что из 1 моля газообразного вещества А2 и 1 моля газообразного вещества В2 образуется 2 моля газообразного вещества АВ, т.е. количество молей газообразных веществ не изменяется, но из двух газообразных веществ (А2 и В2) образуется одно газообразное вещество (АВ), упорядоченность системы возрастает, процесс сопровождается уменьшением 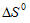 < 0).
< 0).
Из уравнения 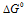 =
=  - T
- T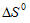 следует, что при
следует, что при 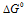 > 0 член равенства (
> 0 член равенства ( ) будет иметь положительное значение. При
) будет иметь положительное значение. При  > 0 член (-T
> 0 член (-T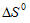 ) будет иметь меньшее целочисленное значение, чем член (
) будет иметь меньшее целочисленное значение, чем член ( ). Отсюда вытекает, что только при очень большом значении множителя (Т) член (-T
). Отсюда вытекает, что только при очень большом значении множителя (Т) член (-T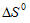 ) станет больше целочисленно, чем член (
) станет больше целочисленно, чем член ( ). Поэтому можно с уверенностью считать, что при
). Поэтому можно с уверенностью считать, что при 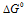 > 0,
> 0,  > 0 и
> 0 и
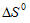 < 0 невозможно протекание процесса при определённом допустимом интервале температур.
< 0 невозможно протекание процесса при определённом допустимом интервале температур.

