Определение направления смещения равновесия в системе. Принцип Ле Шателье
Задача 383.
Какие воздействия на систему 4HCl(г) + O2(г) ⇔ 2Cl2(г) + 2H2O(г) приведут к смещению равновесия влево: а) увеличение концентрации О2; б) увеличение концентрации Cl2; в) повышение давления; г) возрастание объема реакционного сосуда?
Решение:
Уравнение реакции имеет вид:
4HCl(г) + O2(г) ⇔ 2Cl2(г) + 2H2O(г)
а) Увеличение концентрации О2 приведет к смещению равновесия системы, согласно , вправо, в сторону расходования кислорода при реакции.
б) Увеличение концентрации Cl2 приведет к смещению равновесия системы, согласно , влево, в сторону уменьшения хлора при реакции.
в) Повышение давления в системе приведёт смещение равновесия, согласно , вправо, в сторону реакции, идущей с уменьшением числа молей газообразных веществ.
г) При возрастании объёма реакционного сосуда, соответственно, уменьшится давление в системе, поэтому , согласно , произойдёт в сторону реакции, идущей с увеличением числа молей газообразных веществ, т.е. влево.
Таким образом, в данной системе увеличение концентрации Cl2 в 2 раза и возрастание объёма реакционного сосуда приведут смещение равновесия влево.
Ответ: б): г).
Задача 384.
В каком направлении сместится равновесие в системе: 4Fe(к) + 3O2(г) ⇔ 2Fe2O3(к) при увеличении давления: а) в сторону прямой реакции; б) в сторону обратной реакции; в) не сместится?
Решение:
Уравнение реакции имеет вид:
4Fe(к) + 3O2(г) ⇔ 2Fe2O3(к)
Из уравнения реакции следует, что данная реакция протекает с уменьшением, как общего числа молей реагирующих веществ, так и числа молей газообразных веществ, поэтому при увеличении давления в системе, согласно , равновесие сместится вправо, в сторону уменьшения числа молей газообразных веществ.
Ответ: а).
Задача 385.
Какими воздействиями на систему А(г) + В(г) ⇔ АВ(Г) можно увеличить равновесную концентрацию продукта реакции АВ, если  реакции отрицательно: а) введением в систему катализатора; б) повышением температуры; в) понижением температуры; г) введением в реакционный сосуд дополнительного количества вещества В?
реакции отрицательно: а) введением в систему катализатора; б) повышением температуры; в) понижением температуры; г) введением в реакционный сосуд дополнительного количества вещества В?
Решение:
Уравнение реакции имеет вид:
А(г) + В(г) ⇔ АВ(Г)
а) – вещества, которые одновременно увеличивают скорости как прямой, так и обратной реакций, поэтому при введении в систему катализатора равновесные концентрации реагирующих веществ не изменятся.
б) Данная  < 0), поэтому при повышении температуры в системе, согласно , равновесие сместится влево, в сторону эндотермической реакции.
< 0), поэтому при повышении температуры в системе, согласно , равновесие сместится влево, в сторону эндотермической реакции.
в) При понижении температуры в системе, согласно , равновесие сместится вправо, в сторону экзотермической реакции. Поэтому концентрация вещества АВ повысится.
г) При введении в систему дополнительного количества вещества В, согласно , равновесие сместится вправо, в сторону уменьшения концентрации вещества В, поэтому увеличится количество образующегося вещества АВ.
Ответ: в(; г).
Задача 386.
Для некоторой реакции 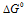 < 0. Какие из приведенных утверждений правильны: а) константа равновесия реакции больше единицы; б) константа равновесия реакции меньше единицы; в) в равновесной смеси преобладают исходные вещества; г) в равновесной смеси преобладают продукты реакции?
< 0. Какие из приведенных утверждений правильны: а) константа равновесия реакции больше единицы; б) константа равновесия реакции меньше единицы; в) в равновесной смеси преобладают исходные вещества; г) в равновесной смеси преобладают продукты реакции?
Решение:
Из 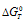 = 2,3RTlgKT вытекает, что отрицательный знак
= 2,3RTlgKT вытекает, что отрицательный знак 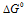 возможен только в том случае, если jgK > 0, т.е. К > 1.
возможен только в том случае, если jgK > 0, т.е. К > 1.
Отрицательное значение 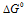 означает, что прямая реакция может самопроизвольно протекать при стандартных условиях (Т = 298 К и Р = 101,325 Па), поэтому в равновесной смеси преобладают продукты реакции.
означает, что прямая реакция может самопроизвольно протекать при стандартных условиях (Т = 298 К и Р = 101,325 Па), поэтому в равновесной смеси преобладают продукты реакции.
Ответ: а); г).
Задача 387.
Для некоторой самопроизвольно протекающей реакции 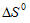 < 0. Как будет изменяться константа равновесия с повышением температуры: а) увеличиваться; б) уменьшаться; в) по данным задачи нельзя определить?
< 0. Как будет изменяться константа равновесия с повышением температуры: а) увеличиваться; б) уменьшаться; в) по данным задачи нельзя определить?
Решение:
Если 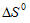 < 0, то с ростом температуры будет возрастать член (-T
< 0, то с ростом температуры будет возрастать член (-T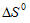 ) равенства
) равенства 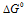 =
=  -T
-T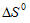 , причём он всегда будет иметь положительное значение при любом числовом значении температуры. Если
, причём он всегда будет иметь положительное значение при любом числовом значении температуры. Если  < 0 и
< 0 и 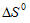 < 0, то реакция возможна при условии, что член (
< 0, то реакция возможна при условии, что член ( ) в равенстве больше, чем член (-T
) в равенстве больше, чем член (-T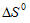 ); поскольку с ростом температуры абсолютное значение члена (-T
); поскольку с ростом температуры абсолютное значение члена (-T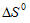 ) возрастает, то, соответственно, будет увеличиваться положительное значение члена (
) возрастает, то, соответственно, будет увеличиваться положительное значение члена (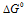 ). Тогда в уравнении энергии Гиббса
). Тогда в уравнении энергии Гиббса 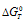 = -2,3RTlgKT при положительном значении члена (
= -2,3RTlgKT при положительном значении члена (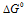 ) член равенства (lgK), будет иметь отрицательное значение, т.е. K < 1. Из чего следует, что при повышении значения множителя (Т) значение члена(lgK ) будет соответственно уменьшаться.
) член равенства (lgK), будет иметь отрицательное значение, т.е. K < 1. Из чего следует, что при повышении значения множителя (Т) значение члена(lgK ) будет соответственно уменьшаться.
Таким образом, для самопроизвольно протекающей реакции при 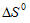 < 0 константа равновесия с повышением температуры будет уменьшаться.
< 0 константа равновесия с повышением температуры будет уменьшаться.
Ответ: б).

