Составление термохимического уравнения реакции и вычисление теплот образования веществ
Теплота образования веществ
Задание 88.
Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений:
а) Н2 (г) + 1/2О2 (г) = Н2О (ж); 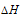 = -285,84 кДж;
= -285,84 кДж;
б) С (к) + О2 (г) = СО2 (г); 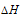 = -393,51 кДж;
= -393,51 кДж;
в) СН4 (г) + 2О2 (г) = 2Н2О (ж) + СО2 (г); 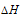 = -890,31 кДж.
= -890,31 кДж.
Ответ: -74,88 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование метана из водорода и углерода можно представить так:
С (графит) + 2Н2 (г) = СН4 (г); 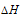 = ?
= ?
Исходя из данных уравнений по условию задачи, учитывая, что водород сгорает до воды, углерод - до углекислого газа, метан – до углекислого газа и воды и, на основании закона Гесса, с термохимическими уравнениями можно оперировать также как и с алгебраическими. Для получения искомого результата нужно уравнение горения водорода (а) умножить на 2, а затем, сумму уравнений горения водорода (а) и углерода (б) вычесть из уравнения горения метана (в):
СН4 (г) + 2О2 (г) - 2 Н2 (г) + О2 (г) - С (к) + О2 (г) =
= 2Н2О (ж) + СО2 - 2Н2О - СО2;
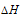 = -890,31 – [-393,51 + 2(-285,84).
= -890,31 – [-393,51 + 2(-285,84).
Отсюда
СН4 (г) = С (к) + 2Н2 (к); 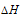 = +74,88 кДж.2
= +74,88 кДж.2
Так как теплота образования равна теплоте разложения с обратным знаком, то
 (СН4) = -74,88 кДж.
(СН4) = -74,88 кДж.
Ответ: -74,88 кДж.
Задание 89.
Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са (к) + 1/2О (г) = СаО (к); 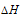 = -635,60 кДж;
= -635,60 кДж;
Н2 (г) + 1/2О2 (г) = Н2О (ж); 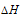 = -285,84 кДж;
= -285,84 кДж;
СаО (к) + Н2О (ж) = Са(ОН)2 (к); 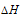 = -65,06 кДж.
= -65,06 кДж.
Ответ: —986,50 кДж.
Решение:
равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование гидроксида кальция из простых веществ можно представить так:
Са (к) + О2 (г) + Н2 (г) = Са(ОН)2 (к); 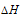 = ?
= ?
Исходя из уравнений, которые даны по условию задачи и, учитывая, что водород сгорает до воды, а кальций, реагируя с кислородом, образует СаО, то на основании закона Гесса с термохимическими уравнениями можно оперировать также как с алгебраическими. Для получения искомого результата нужно все три уравнения сложить между собой:
СаО(к) + Н2О(ж) + Са(к) + 1/2О(г) + Н2(г) + 1/2О2(г) =
= (ОН)2(к) + СаО(к) + Н2О(ж);
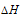 = -65,06 + (-635,60) + (-285,84) = -986,50 кДж.
= -65,06 + (-635,60) + (-285,84) = -986,50 кДж.
Так как стандартные теплоты образования простых веществ условно принята равными нулю, то теплота образования гидроксида кальция будет равна тепловому эффекту реакции образования его из простых веществ (кальция, водорода и кислорода):
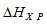 =
=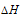 = (Са(ОН)2 = -986,50 кДж.2
= (Са(ОН)2 = -986,50 кДж.2
Ответ: -986,50 кДж.
Задание 90.
Тепловой эффект реакции сгорания жидкого бензина с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6 (ж). Ответ: +49,03 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 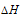 . Значение
. Значение 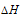 приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жидкое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жидкое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Термохимическое уравнение реакции имеет вид:
С6Н6(ж) + 7/2O2 = 6CO2(г) + 3Н2О(г); 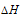 = -3135,58 кДж.
= -3135,58 кДж.
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из :
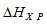 = 6
= 6 (СО2) + 3
(СО2) + 3  =0(Н2О) –
=0(Н2О) –  (С6Н6)
(С6Н6)
Отсюда
 (С6Н6) = [6
(С6Н6) = [6 (СО2) + 3
(СО2) + 3 (Н2О)] -
(Н2О)] - 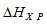 ;
;
 (С6Н6) = [6 -393,51 + 3(-241,83)] - (-3135,58) =
(С6Н6) = [6 -393,51 + 3(-241,83)] - (-3135,58) =
= +49,03 кДж.
Ответ: +49,03 кДж.
Теплота образования
Задание 91.
Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 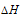 . Значение
. Значение 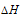 приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жид-кое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жид-кое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Уравнение реакции имеет вид:
С2Н2 (г) + 5/2O2 (г) = 2CO2 (г) + Н2О (г); 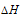 = ?
= ?
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из :
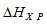 = 2
= 2 (СО2) +
(СО2) +  (Н2О) –
(Н2О) –  (С2Н2);
(С2Н2);
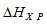 = 2(-393,51) + (-241,83) – (+226,75) =
= 2(-393,51) + (-241,83) – (+226,75) =
= -802,1 кДж.
Термохимическое уравнение будет иметь вид:
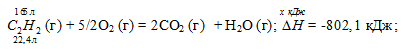
Теплоту, выделившуюся при сгорании 165 л ацетилена по этой реакции, определим из пропорции:
22,4 : -802,1 = 165 : х;
х = 165 (-802,1)/22,4 =
= -5908,35 кДж;
Q = 5908,35 кДж.
Ответ: 5908,35 кДж.
Задание 92.
При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж.
Решение:
Уравнение реакции имеет вид:
NH3 (г) + 5/4O2 = NO (г) + 3/2H2O (г)
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из :
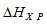 =
=  (NO) + 3/2
(NO) + 3/2 (Н2О) –
(Н2О) –  (NH3);
(NH3);
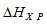 = +90,37 +3/2 (-241,83) – (-46,19) =
= +90,37 +3/2 (-241,83) – (-46,19) =
= -226,185 кДж.
Термохимическое уравнение будет иметь вид:
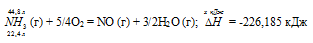
Теплоту, выделившуюся при сгорании 44,8 л аммиака, вычислим из пропорции:
22,4 : -226,185 = 44,8 : х;
х = 44,8 (-226,185)/22,4 =
= -452,37 кДж; Q = 452,37 кДж.
Ответ: 452,37 кДж
Тепловой эффект реакции
Задание 93.
Реакция горения метилового спирта выражается термохимическим уравнением:
СН3ОН (ж) +3/2О2 (г) = СО2 (г) + 2Н2О (ж); 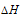 =?
=?
Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования СН3ОН (ж) равна +37,4 кДж. Ответ: -726,62 кДж.
Решение:
(СН3ОН (ж)) = (СН3ОН (г));  = +37,4 кДж;
= +37,4 кДж;
+37,4 кДж = -201,17 - (СН3ОН (ж));
(СН3ОН (ж));
 (СН3ОН (ж)) = -201,17 +(- 37,4) = -238,57кДж.
(СН3ОН (ж)) = -201,17 +(- 37,4) = -238,57кДж.
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из :
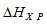 = 2
= 2 (Н2O) +
(Н2O) +  (СО2) –
(СО2) –  ( СН3ОН(ж));
( СН3ОН(ж));
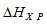 = -393,51 +2 (-285,84) – (-238,57) =
= -393,51 +2 (-285,84) – (-238,57) =
= -726,62 кДж.
Ответ: -726,62 кДж.
Термохимическое уравнение реакции
Задание 94.
При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж). Ответ: —277,67 кДж.
Решение:
Мольная масса С2Н5ОН равна 46,0г/моль.
Находим горения этилового спирта из пропорции:
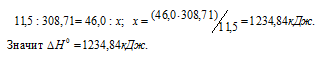
Следовательно, термохимическое уравнение реакции будет иметь вид:
С2Н5ОН (ж) +3О2 (г) =
= 2СО2 (г) + 3Н2О (г); 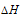 = 1234,84кЛж. (1)
= 1234,84кЛж. (1)
Обозначим искомую величину через х, запишем термохимическое уравнение образования С2Н5ОН из простых веществ:
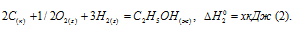
Запишем также термохимические уравнения образования СО2(г) и Н2О(ж):
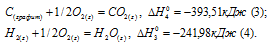
Из уравнений (2), (3) и (4) можно получить уравнение (5). Для этого умножим уравнение (4) на три, уравнение (2) - на два, а затем из суммы уравнений (3) и (4) вычтем уравнение (2), получим:
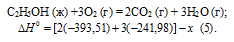
Сравнивая уравнения (1) и (5), находим:
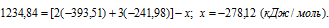
Ответ:  (С2Н5ОН) = -278,12 кДж/моль.
(С2Н5ОН) = -278,12 кДж/моль.

